Nieskazitelne standardy: opanowanie kontroli zanieczyszczeń w środkach higieny osobistej i kosmetykach
Na podstawie artykułu pierwotnie opublikowanego w wydaniu Personal Care Magazine z 2025 czerwca.

Ustal powtarzalną i przejrzystą procedurę, aby mieć pewność, że dokładnie przejdziesz wizualną ocenę czystości u różnych operatorów.
Wyobraź sobie, że jedno uchybienie w procedurze czyszczenia nadszarpnęło reputację Twojej marki w ciągu zaledwie kilku dni. Od tego, co wydawało się być zwykłym błędem w procedurze mycia i dezynfekcji (C&S), masz teraz do czynienia z wycofaniem produktu i komunikatem prasowym w celu ostrzeżenia konsumentów, formalną analizą przyczyn i planem działań naprawczych, a także wieloma innymi obowiązkami. Koszty finansowe i koszty reputacji są oszałamiające, a potencjalne ustalenia Agencji ds. Żywności i Leków (FDA) zwiększają obciążenie. Masz teraz godziny, dni, a nawet tygodnie na rozwiązanie problemu, któremu można było łatwo zapobiec dzięki odpowiednim kontrolom C&S. W świecie kosmetyków zapewnienie nieskazitelnej czystości sprzętu to nie tylko zgodność z przepisami, ale także ochrona zaufania i zdrowia konsumentów.
W większości przypadków przepisy na całym świecie wymagają, aby produkty higieny osobistej i kosmetyki nie były fałszowane lub zanieczyszczone. Producent musi spełnić te przepisy, kontrolując krytyczne etapy procesu produkcyjnego, aby zapewnić, że nie dojdzie do zanieczyszczenia. W procesach produkcji i pakowania, czyszczeniu, higienie pracowników, higienie zakładu, kontroli surowców i szkoleniu pracowników można wprowadzić różne kontrole. Publikacja projektu Obecnych Dobrych Praktyk Produkcji (cGMP) Ustawy o Modernizacji Przepisów Kosmetycznych (MoCRA) jest nadal w toku, a wraz z nią pojawiają się spekulacje na temat tego, co będzie, a co nie będzie wymagane. Międzynarodowa norma GMP dla kosmetyków, ISO 22716:2007, może być przywoływana jako wskazanie potencjalnych wytycznych, które mogą mieć wpływ na projekt GMP MoCRA. Na przykład ISO 22716:2007 - 4.10.3 i 4.10.4 wymaga określonych środków czyszczących i/lub odkażających, które są weryfikowane pod względem skuteczności oraz są wybierane i stosowane zgodnie ze specyficznymi potrzebami każdego obszaru obiektu. Innymi słowy, różne obszary zakładu mogą wymagać różnych procedur SOP dotyczących sprzątania, a każda z nich musi zostać zweryfikowana pod kątem skuteczności. Innym przykładem jest norma ISO 22716:2007 - 7.2, która podkreśla znaczenie między innymi dokumentacji, identyfikowalności, kontroli jakości i zarządzania partiami. Przedstawia to dążenie branży do przejścia na ideologię "First Time Right" (FTR), zapewniając, że operacje są gotowe do audytu, a produkty są wytwarzane i dostarczane zgodnie ze specyfikacją.
Ostatecznie te wytyczne cGMP pomagają zmniejszyć ryzyko zanieczyszczenia i dają firmom pewność, że dostarczają swoim konsumentom bezpieczne i wysokiej jakości produkty. Trzeba przyznać, że każdy nowy GMP może na początku onieśmielać. Biorąc pod uwagę, że C&S jest kluczowym elementem dobrej praktyki produkcyjnej, niniejszy artykuł przeprowadzi Cię przez ryzyko i najlepsze praktyki związane z procedurami sprzątania najważniejszego sprzętu do przetwórstwa.
Koszt brudnego sprzętu
W połączonym cyfrowo świecie, w którym żyjemy, w ciągu kilku dni marka firmy może być negatywnie dotknięta za pośrednictwem mediów społecznościowych, gdy „wady” produktu dostaną się w ręce konsumenta. Podobnie doniesienia o wynikach audytu regulacyjnego lub wycofaniu produktu z rynku mogą zaszkodzić wizerunkowi marki. Te wady lub wyniki audytu mogą mieć wiele przyczyn, w tym pozostałości przeniesione z poprzedniej produkcji w wyniku nieodpowiedniego czyszczenia lub zmiany zapachu i lepkości spowodowane zanieczyszczeniem mikrobiologicznym. Głównym powodem, dla którego producenci sprzątają to minimalizacja ryzyka zanieczyszczenia produktu. Rodzaje zanieczyszczeń obejmują zanieczyszczenie krzyżowe produktu, zanieczyszczenie krzyżowe substancji czynnych, zanieczyszczenie mikrobiologiczne, a nawet zanieczyszczenie środkami czyszczącymi. Biorąc pod uwagę te zagrożenia, kluczowe znaczenie ma zrozumienie standardów czystości wymaganych do zapewnienia bezpieczeństwa i jakości produktów. To prowadzi nas do pytania: „Jak czysty jest wystarczająco czysty?
Jak czysty jest wystarczająco czysty?
To, ile należy wyczyścić, aby uniknąć zanieczyszczenia, wydaje się subiektywne i otwarte na interpretację. Na potrzeby dyskusji należy wziąć pod uwagę, że poziomy czystości mogą być oceniane w trzech stopniach czystości - wizualnie czyste, wolne od pozostałości lub czyste pod kątem mikrobiologicznym. Chociaż te poziomy czystości są powiązane, każdy z nich wiąże się z różnymi poziomami ryzyka dla konsumenta. Organy regulacyjne odpowiedzialne za zapewnienie bezpieczeństwa konsumentów dostarczyły wskazówki. W kolejnych sekcjach omówiono każdy poziom, związane z nim zagrożenia i potencjalne rozwiązania.
1. Czystość wizualna
ISO dostarcza normę czystości dla przemysłu, która mówi o „czystości wizualnej” w ISO 22716 - 2007: Kosmetyki – Dobre Praktyki Produkcji (GMP)2, gdzie czyszczenie jest opisane jako „ oddzielanie i eliminowanie ogólnie widocznych zabrudzeń z powierzchni” (sekcja 2.8). Norma ta nakazuje usunięcie z powierzchni sprzętu wszystkich widocznych zabrudzeń.
Ze wszystkich rodzajów zanieczyszczeń norma ta wydaje się najprostsza do osiągnięcia i potwierdzenia; Jednak w praktyce nie zawsze tak jest. Definiowanie „stanu początkowego” lub punktu wyjścia może być niejednoznaczne. Na przykład, co jeśli zbiornik jest zabarwiony, zużyty, lub w jakiś sposób uszkodzony, tak, że nikt nie pamięta już pięknego blasku nowej stali nierdzewnej? Jak ustalić standard czystości wizualnej? W takiej sytuacji można przeprowadzić naprawę lub pasywację zbiornika, aby przywrócić sprzęt do „stanu podstawowego” lub wyglądu jak nowy. Innym rozwiązaniem są badania (pozostałości, drobnoustrojów) i ocena ryzyka, grupa ds. kontroli jakości i grupa produkcyjna mogą ustalić najlepszy stan obecny i nowy stan wyjściowy.
Jak więc zmierzyć wizualną czystość? Czystość wizualna to metoda badawcza wymagająca procedury, standaryzacji i być może kalibracji. Przyjrzyjmy się trzem kluczowym zmiennym, które pomagają określić, co jest uważane za wizualnie czyste: warunki oświetleniowe, warunki powierzchniowe i przyrząd pomiarowy.
Oświetlenie, lub jego brak, mogą wpłynąć na możliwość wyraźnego oglądania powierzchni. W związku z tym procedura kontroli C&S musi zawierać definicję oświetlenia – określającą źródło światła, typ żarówki, kąt świecenia i tak dalej. Konserwacja tego źródła światła może być również konieczna, ponieważ stan żarówki może się pogorszyć z czasem. Czasami konieczny może być plan konserwacji zapobiegawczej dla źródła światła.
Istotny jest również stan kontrolowanej powierzchni. Na przykład mokra powierzchnia może wyglądać inaczej niż sucha i może ukrywać obecność resztek gleby. W związku z tym w procedurze należy określić stan powierzchni, tj. czy jest mokra czy sucha podczas przeprowadzania kontroli.
Operator jest podstawowym „narzędziem” lub urządzeniem testowym w wizualnej ocenie czystości. Operator musi zostać oceniony lub zakwalifikowany jako zdolny do przeprowadzenia inspekcji. Ostrość widzenia, soczewki korekcyjne i umiejętność rozróżniania kolorów mogą mieć kluczowe znaczenie dla zakwalifikowania technika do wizualnej oceny czystości. Po ustaleniu zdolności technik powinien zostać przeszkolony w zakresie właściwych technik kontroli zgodnych z pisemną procedurą.
Po uzgodnieniu wymagań dotyczących procedury należy ustalić kryteria testu. Ponieważ żaden wynik testu numerycznego nie jest powiązany z oceną wizualną, konieczny jest standard wizualny, aby zapewnić spójny pomiar względem kryteriów sukcesu. Często osiąga się to poprzez wizualny standard tworzony ze zdjęć akceptowalnych i niedopuszczalnych widoków. Wyniki należy udokumentować po każdym sprzątaniu. Te standardy wizualne pomagają zmniejszyć ryzyko, które towarzyszy posiadaniu wielu wykwalifikowanych operatorów do przeprowadzenia testu wizualnego. Chociaż formaty papierowe i cyfrowe są dopuszczalne do przechowywania tych procedur, istnieje wiele zalet korzystania z formatu cyfrowego; Zalety te obejmują między innymi bardziej interaktywne i angażujące doświadczenie szkoleniowe dla operatorów oraz solidną dokumentację i identyfikowalność danych historycznych w celu przygotowania do audytu.
2. Resztkowa czystość
Nawet jeśli sprzęt jest czyszczony zgodnie ze standardami „czystości wizualnej”, pozostałości obecne w niewidocznych ilościach mogą mieć wpływ na bezpieczeństwo konsumentów. Na przykład niektóre substancje czynne, takie jak chemiczne składniki filtrów przeciwsłonecznych, nie są wykrywalne wizualnie. Ponadto detergenty mogą pozostawiać pozostałości wpływające na jakość produktu, jeśli nie zostaną odpowiednio spłukane, co może być niemożliwe do wykrycia podczas kontroli wizualnej.
Usunięcie wszystkich wykrywalnych poziomów produktu, substancji czynnych i detergentów w celu zapewnienia czystej powierzchni nie jest ekonomiczne dla producentów, ponieważ może to wymagać zbyt dużej ilości czasu i wody. W zależności od branży, agencje regulacyjne mogą przyjąć podejście oparte na ryzyku, wymagając, aby pozostałości zostały zredukowane do „bezpiecznego poziomu” do użytku przez klienta. Często ten „bezpieczny poziom” opiera się na ocenie toksykologicznej, zapewniając, że ilość resztek przeniesiona do następnej partii jest znacznie poniżej poziomu obserwowalnych efektów lub niepożądanych zdarzeń. Wymaga to od producentów znajomości pozostałości, które mogą być obecne, bezpiecznego i akceptowalnego poziomu pozostałości, metody badania w celu weryfikacji poziomu pozostałości oraz procesu czyszczenia, który niezawodnie usuwa produkt, substancje czynne i detergent do tego bezpiecznego poziomu. Producent kosmetyków zna swoją recepturę, a więc zna substancje czynne lub składniki receptury, które mogą pozostać jako pozostałości, oraz związane z tym działanie lub toksyczność. Zazwyczaj mają już opracowaną metodę badawczą dla substancji czynnej, ponieważ prawdopodobnie badają końcowy skład produktu, aby sprawdzić, czy jest on zgodny ze specyfikacją. Ta metoda badawcza może wymagać weryfikacji lub modyfikacji w celu dokładnego pomiaru niższych pozostałości substancji czynnych po czyszczeniu. Często niespecyficzne badanie, takie jak metoda badawcza na obecność ogólnego węgla organicznego (OWO), może zweryfikować, czy nieaktywne składniki preparatu zostały usunięte.
Większą niewiadomą dla producentów kosmetyków może być środek myjący. Renomowany dostawca będzie w stanie udostępnić informacje o toksyczności środka oraz odpowiednie metody testowe do wykrywania pozostałości. W przemyśle metody badań mogą być specyficzne (rozpoznający konkretny składnik chemiczny) lub niespecyficzne (wskazujące na obecność pozostałości, ale nie konkretnej substancji chemicznej) w oparciu o ocenę ryzyka toksyczności. Często detergenty używane w kosmetykach są obarczone niskim ryzykiem i mogą być testowane niespecyficznymi metodami. Przykłady obejmują ogólny węgiel organiczny (OWO), przewodność, pH itp. W każdym z tych przypadków wymagane jest wykonanie badań laboratoryjnych, aby zapewnić korelację lub translację niespecyficznego wyniku badania na rzeczywisty poziom pozostałości. Producent środków myjących powinien być w stanie pomóc w tej kwestii.
Osiągnięcie czystości resztkowej ma kluczowe znaczenie dla eliminacji ukrytych zanieczyszczeń, ale równie ważne jest przeciwdziałanie zagrożeniom mikrobiologicznym, które mogą zagrozić bezpieczeństwu produktu. W ten sposób dochodzimy do ostatniego poziomu czystości: zapewnienia czystości mikrobiologicznej sprzętu.
3. Czystość mikrobiologiczna
Zanieczyszczenie mikrobiologiczne spowodowane obciążeniem biologicznym sprzętu staje się coraz poważniejszym problemem i budzi zainteresowanie w przemyśle kosmetycznym. Doprecyzowanie pojęć jest konieczne, zanim zbadamy możliwości kontroli zanieczyszczenia mikrobiologicznego. Dwa terminy, które mylą globalną sferę – sanityzacja i dezynfekcja. W normach EPA i USP redukcja obciążenia mikrobiologicznego jest określana jako sanityzacja, podczas gdy dezynfekcja jest definiowana jako niszczenie lub nieodwracalna inaktywacja mikroorganizmów. W tym artykule będziemy używać terminu sanityzacja w znaczeniu redukcji obciążenia mikrobiologicznego do pożądanego poziomu, niezależnie od położenia geograficznego aplikacji.
Po osiągnięciu poziomu czystości wizualnej i poziomu czystości pod kątem pozostałości, na sprzęcie pozostają potencjalne pozostałości mikrobiologiczne, które mogą zanieczyścić kosmetyk. Jeśli zanieczyszczenie mikrobiologiczne jest ekstremalne, jak w przypadku śliskiego, odbarwionego obszaru wskazującego na obecność biofilmu, problem może zostać wykryty podczas kontroli wizualnej. Często zanieczyszczenie mikrobiologiczne wykrywane jest dopiero podczas badania gotowego produktu, a wysoka liczba mikroorganizmów powoduje odrzucenie partii. Nawet jeśli historia nie wskazuje na problemy z zanieczyszczeniem mikrobiologicznym produktów wytwarzanych w zakładzie, obecne trendy produktowe zmierzają w kierunku bardziej naturalnych składników, co może zwiększyć potencjał wprowadzania wcześniej niespotykanej flory mikrobiologicznej. Ponadto, możliwa do stosowania liczba konserwantów zmniejsza się, ponieważ UE wycofuje je z użycia w kosmetykach, co oznacza mniejszą odporność receptury na rozwój mikroorganizmów i zanieczyszczenia.

Bez odpowiednich procedur czyszczenia i dezynfekcji sprzęt jest narażony na rozwój mikroorganizmów, które mogą objawiać się biofilmem na wnętrzu sprzętu
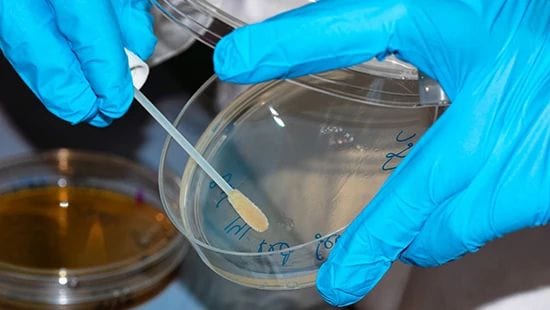
Mikrowymazy to jedna z powszechnych metod badania pozostałości mikrobiologicznych.
Pozostałości mikrobiologiczne mogą być mierzone poprzez pobranie wymazu lub próbek wody z płukania, w zależności od konstrukcji i stanu sprzętu. Badania pozostałości mikrobiologicznych wiążą się z wyjątkowymi wyzwaniami związanymi przede wszystkim z dostępem do punktów pobierania próbek. Często obszary o najwyższym ryzyku mikrorozwoju to miejsca, do których nie ma łatwego dostępu, takie jak rury, połączenia urządzeń lub, w niektórych przypadkach, powierzchnie sprzętu uszkodzone przez wyżłobienia lub wżery. Miejsca trudno dostępne do pobierania próbek są również najtrudniejsze do skutecznego czyszczenia, co zwiększa ryzyko.
Podstawową metodą kontroli pozostałości mikroorganizmów na czyszczonym sprzęcie jest etap sanityzacji. Producenci środków higieny osobistej i kosmetyków w przeszłości stosowali dezynfekcję termiczną w celu zmniejszenia pozostałości mikroorganizmów. Wspomniane powyżej trendy recepturowe kosmetyków zwiększają znaczenie zapobiegania zakażeniom w sprzęcie produkcyjnym. Dalsze wywieranie nacisków na kontrolę kosztów i zmniejszenie zużycia energii powoduje, że firmy odchodzą od często stosowanej sanityzacji gorącą wodą na rzecz sanityzacji chemicznej. Pewność, że proces termiczny jest skuteczny i działa w zatwierdzonym stanie, w dużym stopniu zależy od temperatury i czasu stosowania wszystkich punktów styku sprzętu. Coraz bardziej popularna staje się sanityzacja produktów, której skuteczność mikrobiologiczna została zatwierdzona przy użyciu określonego produktu, stężenia i czasu kontaktu z powierzchnią – często w temperaturze otoczenia i w zaledwie kilka minut.
Podsumowanie
Zapewnienie, że produkty higieny osobistej i kosmetyki są produkowane w środowisku wolnym od zanieczyszczeń, ma zasadnicze znaczenie dla zdrowia i bezpieczeństwa konsumentów. Jednym z kluczowych kroków, jakie może podjąć producent, jest opracowanie programu czyszczenia i dezynfekcji, który skutecznie usuwa zanieczyszczenia pochodzące z produkcji. Tymi zanieczyszczeniami mogą być pozostałości produktów (substancje aktywne lub nie), detergenty lub obciążenie mikrobiologiczne. Czyszczenie do standardu „czystości wizualnej” jest konieczne i nie podlega negocjacjom jako punkt wyjścia. Opracowanie standardu – procesu, limitów akceptacji i szkoleń – ma kluczowe znaczenie.
Zbadaliśmy fakt, że osiągnięcie „czystości wizualnej” może nie wystarczyć. Pozostałości, które nie są widoczne, takie jak pozostałości substancji czynnych, pozostałości detergentów lub obciążenia mikrobiologiczne, mogą przyczyniać się do zanieczyszczenia wpływającego na jakość produktu. Programy czyszczenia i sanityzacji muszą rygorystycznie uwzględniać wszystkie te rodzaje pozostałości, aby zapewnić, że nie wpłynie to na jakość produktu.
Aby mieć pewność, że Twoje produkty spełniają najwyższe standardy czystości i bezpieczeństwa, rozważ współpracę z ekspertami specjalizującymi się w kontroli zanieczyszczeń. Dzięki temu możesz chronić reputację marki, chronić zdrowie konsumentów i wyprzedzać wymogi prawne. Nie czekaj na problem ze skażeniem — już teraz podejmij proaktywne kroki, aby wdrożyć solidny program czyszczenia i dezynfekcji.

Pokonywanie wyzwań na hali produkcyjnej
Ecolab może zoptymalizować procesy produkcji środków higieny osobistej.
Osiągnij znaczne oszczędności czasu i kosztów.
Źródła
- Załącznik 15 wytycznych UE GMP stanowi, że „limity przenoszenia pozostałości produktu powinny być oparte na ocenie toksykologicznej. Uzasadnienie wybranych limitów powinno być udokumentowane w ocenie ryzyka, która zawiera wszystkie uzupełniające odniesienia”.
- Źródło: https://www.epa.gov/pesticide-registration/pesticide-registration-manual-chapter-4-additional-considerations
- Źródło: USP Rozdział 1072



