Znaczenie ochrony procesu testowania sterylności
Próbki produktów są pobierane w trakcie całego procesu produkcyjnego i testowane pod kątem zanieczyszczenia mikrobiologicznego. W większości przypadków test sterylności wykaże, że produkt jest wolny od zanieczyszczeń, co umożliwia jego wysyłkę. Jeśli wyniki wskazują, że produkt jest zanieczyszczony, dostawa jest wstrzymywana, aby zapobiec narażeniu pacjentów na potencjalne ryzyko.
Jeśli proces sterylności nie jest odpowiednio zabezpieczony, zanieczyszczenie ze środowiska może mieć wpływ na wyniki testu i wskazywać, że produkt jest zanieczyszczony, gdy tak nie jest. Wycofanie partii może skutkować znacznymi kosztami dla producenta i potencjalnymi niedoborami leków dla pacjentów. Chroń proces testowania sterylności przed zanieczyszczeniem z otaczającego środowiska, aby zmniejszyć ryzyko występowania wyników fałszywie dodatnich.
Niezależnie od tego, czy stosowana metoda to filtracja membranowa, czy bezpośredni posiew, izolator może zapewnić wyraźne korzyści.

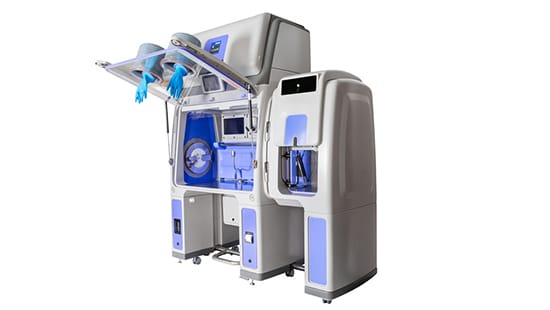
Poznaj nasz izolator do testów sterylności
Izolator Bioquell Qube od Ecolab zapewnia aseptyczne środowisko ISO 5 / klasy A oraz korzysta ze zintegrowanej technologii Bioquell Hydrogen Peroxide Vapor* z parą nadtlenku wodoru, zapewniającą zwalidowaną skuteczność sporobójczą 6-log na odsłoniętych powierzchniach w obszarach działania. Od polimerowych elementów po integrację z pompą sterylności Symbio Flex firmy Merck Millipore, Bioquell Qube jest naprawdę wyjątkowym i idealnym rozwiązaniem do testów sterylności.
*W przypadku stosowania zgodnie z instrukcją na etykiecie, systemy Ecolab Bioquell wykorzystują nadtlenek wodoru Bioquell Hydrogen Sterilant-AQ (numer rejestracyjny EPA: 1677-277)
Czy izolator jest właściwym wyborem dla Ciebie? Czy masz odpowiedni izolator?
Co oznaczałby dla Ciebie problem lub wynik fałszywie dodatni?
Wstrzymanie produkcji z powodu wyniku fałszywego pozytywnego może prowadzić do znacznych przestojów, niepotrzebnego wycofania produktu, niedoborów leków i może potencjalnie obniżyć pozycję firmy na rynku. Ponadto należy uwzględnić dodatkowy czas, pracę i koszty związane z etapami systemu CAPA.
Ile miejsca w pomieszczeniu sterylnym wymaga sprzęt?
Przestrzeń pomieszczeń sterylnych zwykle musi zoptymalizowana, ponieważ ceny za metr kwadratowy budowy i eksploatacji przestrzeni mogą być wysokie. Izolator taki jak Bioquell Qube zajmuje niewielką powierzchnię, w razie potrzeby można go łatwo przenosić, nie wymaga prac budowlanych i działa w obszarach o niższej klasy sterylności. Aby uzyskać specyfikację, prosimy o kontakt z Ecolab.
Czy testowanie sterylności wymaga pomieszczenia sterylnego klasy B?
Dzięki izolatorom można przeprowadzać testy w pomieszczeniach sterylnych niższej klasy, które wymagają mniej lub wręcz żadnej odzieży ochronnej. Dodatkowo, cenna przestrzeń w pomieszczeniach sterylnych może zostać zaoszczędzona na inne krytyczne działania i może pomóc obniżyć koszty operacyjne, ponieważ pomieszczenia sterylne wyższej klasy wymagają większych inwestycji finansowych związanych z kosztami potrzebnej energii i konserwacji.
Czy obecny proces jest zweryfikowany i powtarzalny?
Zautomatyzowana biodekontaminacja przychodzących materiałów jest zwalidowanym procesem, gwarantującym taką samą skuteczność w każdym cyklu. Pomaga to dodatkowo zmniejszyć ryzyko występowania wyników fałszywie pozytywnych.
Ile testów sterylności należy wykonać w ciągu jednego dnia?
Przestrzeń pomieszczeń sterylnych zwykle musi zoptymalizowana, ponieważ ceny za metr kwadratowy budowy i eksploatacji przestrzeni mogą być wysokie. Izolator taki jak Bioquell Qube zajmuje niewielką powierzchnię, w razie potrzeby można go łatwo przenosić, nie wymaga prac budowlanych i działa w obszarach o niższej klasy sterylności. Izolator Bioquell Qube może wykonać do 60 testów dziennie w zależności od jego konfiguracji. Aby uzyskać specyfikację, prosimy o kontakt z Ecolab.
Czy Twój zakład zleca proces testowania sterylności innym firmom?
Istnieją korzyści wynikające z wykonywania procesu w zakładzie: większa kontrola nad procesem, długoterminowe oszczędności finansowe i szybsze wyniki. Wybór izolatora, który można umieścić w obszarach CNC lub pomieszczeniach sterylnych niższej klasy, umożliwia to pomimo początkowych kosztów związanych z zakupem sprzętu.

Wpływ niezdania testu
Wpływ niezdania testu może być znaczący dla producentów farmaceutyków, ponieważ zazwyczaj skutkuje:
- Wstrzymaniem dystrybucji i potencjalnym wycofaniem partii produktu, która nie przeszła testu.
- Przeprowadzeniem dodatkowego czyszczenia i dezynfekcji obszarów produkcyjnych
- Interwencją prawną
- Stratami finansowymi dla producenta
- Przeprowadzaniem dochodzeń
- Problemami z dostępnością leków dla pacjentów
- Wstrzymaniem produkcji innych produktów podczas przeprowadzenia dochodzenia
Jednak nieprawidłowe wyniki testów sterylności nie zawsze są spowodowane zanieczyszczeniem produktu.
Wynik fałszywie pozytywny może wystąpić, gdy zanieczyszczenie pochodzące ze środowiska lub pracownika przeprowadzającego test przedostanie się do testu i spowoduje jego niepowodzenie. Produkt zostanie uznany za zanieczyszczony, gdy w rzeczywistości jest wolny od szkodliwych mikroorganizmów.
W przypadku niezaliczenia testu sterylności ciężar udowodnienia spoczywa na producencie, który musi wykazać, że niezaliczenie testu jest wynikiem zanieczyszczenia pochodzącego od pracownika lub środowiska laboratoryjnego. Jest to trudne zadanie. W rezultacie fałszywie pozytywne wyniki często prowadzą do niepotrzebnego wycofania zgodnych z regulacjami i skutecznych produktów.
Ochroń swój biznes z izolatorem do testowania sterylności

Wytyczne regulacyjne dotyczące izolatorów:
- Sekcja 10.6 Załącznika 1 EU GMP mówi:
„Test sterylności powinien być przeprowadzony w warunkach aseptycznych”
- Wytyczne FDA dla przemysłu dotyczące sterylnych produktów leczniczych wytwarzanych w procesie aseptycznym idą o krok dalej i stanowią w sekcji XI:
„Wykorzystanie izolatorów do testów sterylności minimalizuje ryzyko otrzymania fałszywie dodatniego wyniku testu"
- Zgodnie z załącznikiem EU GMP 1, izolator to:
„Obudowa, która może być poddana powtarzalnej, wewnętrznej dekontaminacji biologicznej z wewnętrzną strefą roboczą spełniającą warunki klasy A, która zapewnia bezkompromisową, ciągłą izolację jej wnętrza od środowiska zewnętrznego"

Izolatory posiadają szereg funkcji zapewniających ochronęprocesów aseptycznych w tym:
- Hermetyczne/nadmuchiwane uszczelki we wszystkich drzwiach
- Blokady zapobiegające otwarciu drzwi po osiągnięciu warunków aseptycznych (po biodekontaminacji)
- Jednokierunkowy przepływ powietrza w zakresie 0,36-0,45 m/s (w celu zapewnienia zgodności z wartościami wytycznych z Załącznika 1) UE GMP.
- Filtry HEPA do oczyszczania wpływającego powietrza
- Różnice ciśnień, oddzielne testy ciśnieniowe obudowy i rękawic
- Systemy monitorowania potwierdzające, że środowisko pozostaje aseptyczne podczas użytkowania
- Alarmy przepływu powietrza i ciśnienia
- System biodekontaminacji oparami nadtlenku wodoru osiągający skuteczność sposobójczą 6-log* do wyeliminowania skażenia powierzchni obudowy i materiałów wejściowych potrzebnych do procesu testowania
*W przypadku stosowania zgodnie z instrukcją na etykiecie, systemy Ecolab Bioquell wykorzystują nadtlenek wodoru Bioquell Hydrogen Sterilant-AQ (numer rejestracyjny EPA: 1677-277)
Korzyści wynikające z korzystania z izolatorów
Izolatory głównie zmniejszają ryzyko wystąpienia wyników fałszywie dodatnich w testach sterylności, co może zaoszczędzić producentom produktów sterylnych miliony dolarów, minimalizując niepotrzebne wycofania produktów.
Dodatkową korzyścią jest fakt, że izolatory mogą również zapewnić znaczne oszczędności wynikające z kosztów operacyjnych.
W przeciwieństwie do komór bezpieczeństwa biologicznego lub okapów z laminarnym przepływem powietrza, które muszą być umieszczone w pomieszczeniach sterylnych klasy B, izolatory mogą być umieszczone w pomieszczeniach sterylnych niższej klasy C/D. Może to przynieść znaczne oszczędności wynikające z:
- Niższych rachunków za energię wynikających z niższej wydajności systemu HVAC
- Wymaganemu mniejszemu wkładowi pracy (do czyszczenia i dezynfekcji)
- Mniejszej konserwacji pomieszczeń sterylnych
- Niższych kosztów materiałów eksploatacyjnych do czyszczenia i dezynfekcji
- Mniej restrykcyjnych strojów ochronnych
- Zwiększonej wydajności pracy pracowników, ponieważ mniej restrykcyjne stroje oznaczają, że mogą oni pracować przez dłuższy czas
1Koszt pomieszczenia sterylnego w przeliczeniu na metr kwadratowy, Cleanroom Technology, 28 lutego 2018 roku.


Porównanie tradycyjnych izolatorów ze stali nierdzewnej z Bioquell Qube